【文献解读】CRISPR敲入策略实现肿瘤限制性有效载荷递送
CRISPR敲入

新型嵌合抗原受体(Chimeric Antigen Receptor,CAR)T细胞疗法在血液系统恶性肿瘤治疗中已取得显著成效。然而,由于肿瘤微环境中的免疫抑制、肿瘤抗原异质性以及CAR-T细胞向肿瘤部位迁移受限等多重因素的影响,该疗法在实体瘤治疗中仍面临疗效不足的挑战。
2025年7月,《Nature》在线发表了题为"Rewiring endogenous genes in CAR-T cells for tumour-restricted payload delivery"的研究论文,研究团队开发了一种CRISPR敲入策略,即利用内源基因的调控机制实现肿瘤局部化转基因表达。结果显示,CAR-T细胞疗法抗肿瘤疗效显著且无毒性,提升多种模型小鼠生存率,并适用于患者来源CAR-T细胞。

原文链接:https://doi.org/10.1038/s41586-025-09212-7
文章亮点
1. 优异的治疗效果:
NR4A2/IL-12小鼠CAR-T细胞在不同肿瘤模型中抗肿瘤活性均显著增强,即使是进展期肿瘤(>30 mm²),也能有效控制肿瘤生长并显著延长小鼠生存期。
2. 更高的灵活性:
CRISPR敲入策略可根据目标转基因的特性选择合适的启动子。
3. 简化临床生产流程:
通过“一步法”将CAR靶向敲入TRAC位点,并将IL-12或IL-2分别敲入NR4A2或RGS16位点,其CAR表达水平、转基因敲入效率及体内疗效均与“两步法”相当。
为验证所提出的CRISPR基因敲入策略,研究人员选择Pdcd1作为原型基因,设计了同源重组修复模板,将绿色荧光蛋白(GFP)插入到Pdcd1起始密码子下游,并提出了在原代小鼠T细胞中进行高效编辑的实验方案。
实验观察到,经过PD-1/GFP编辑的OT-I细胞在受刺激后,GFP表达明显上升。该结果说明通过对内源性Pdcd1启动子的编辑,成功实现了对GFP表达的控制。随后,将设计的OT-I细胞移植到小鼠体内,发现约80%的OT-I细胞在肿瘤中表达PD-1,而在脾脏中PD-1表达极少。综上实验结果表明,Pdcd1启动子可驱动肿瘤限制性转基因表达。
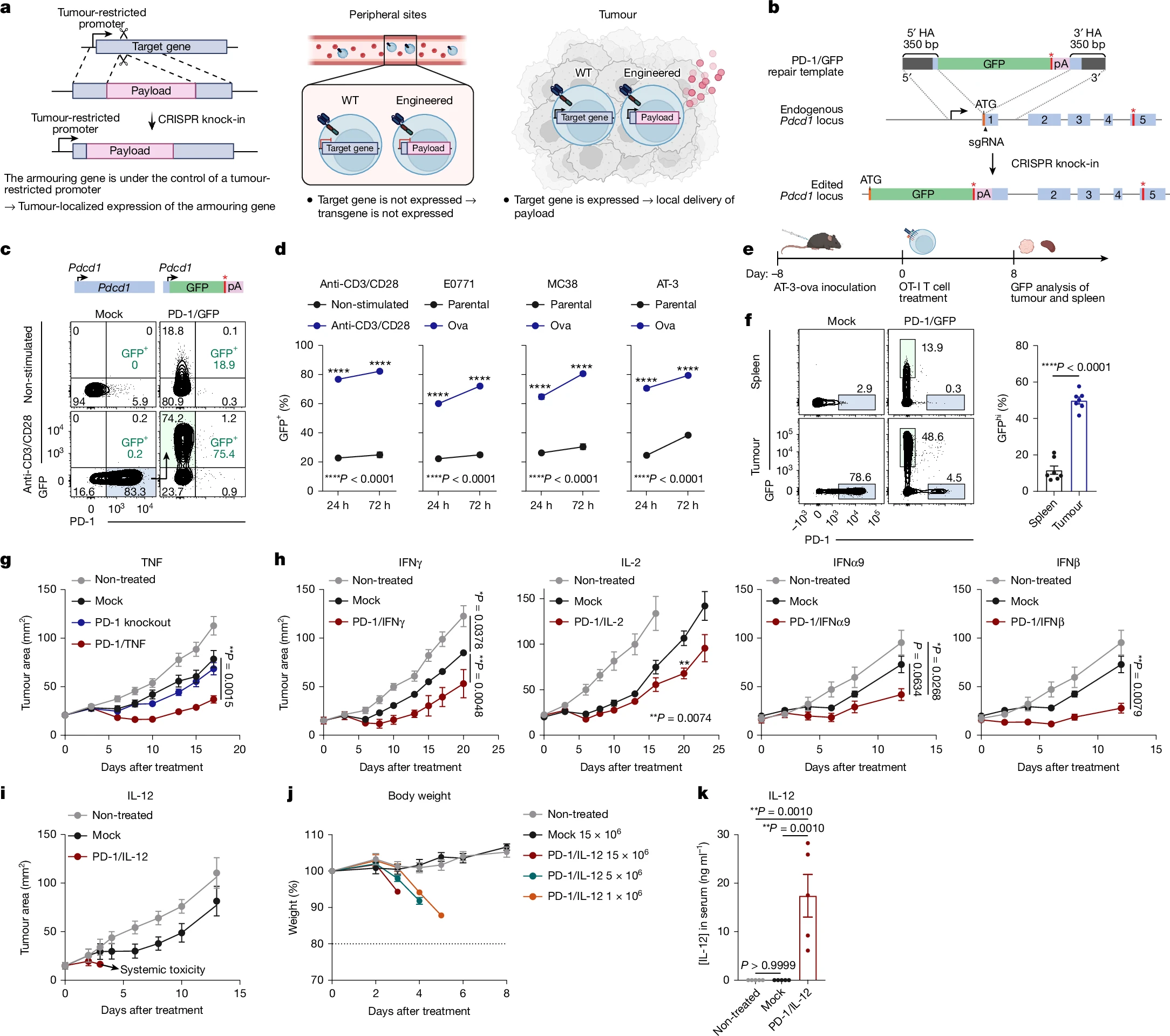
图 1. CRISPR敲入策略开发装甲T细胞
为筛选替代靶基因,研究人员对细胞模型中分离的CD8+ CAR-T细胞进行了RNA测序,并依据数据集相关性初步锁定27个候选基因。
随后,他们在人类抗LeY CAR-T细胞中对这27个基因进行基因敲除,并以细胞因子生成能力为指标,进一步聚焦CLU、NR4A2、PDCD1、RGS1、RGS16和RGS2等基因。
最后,通过评估这些基因驱动肿瘤特异性GFP表达的效率,研究团队确认NR4A2和RGS16为理想的启动子。
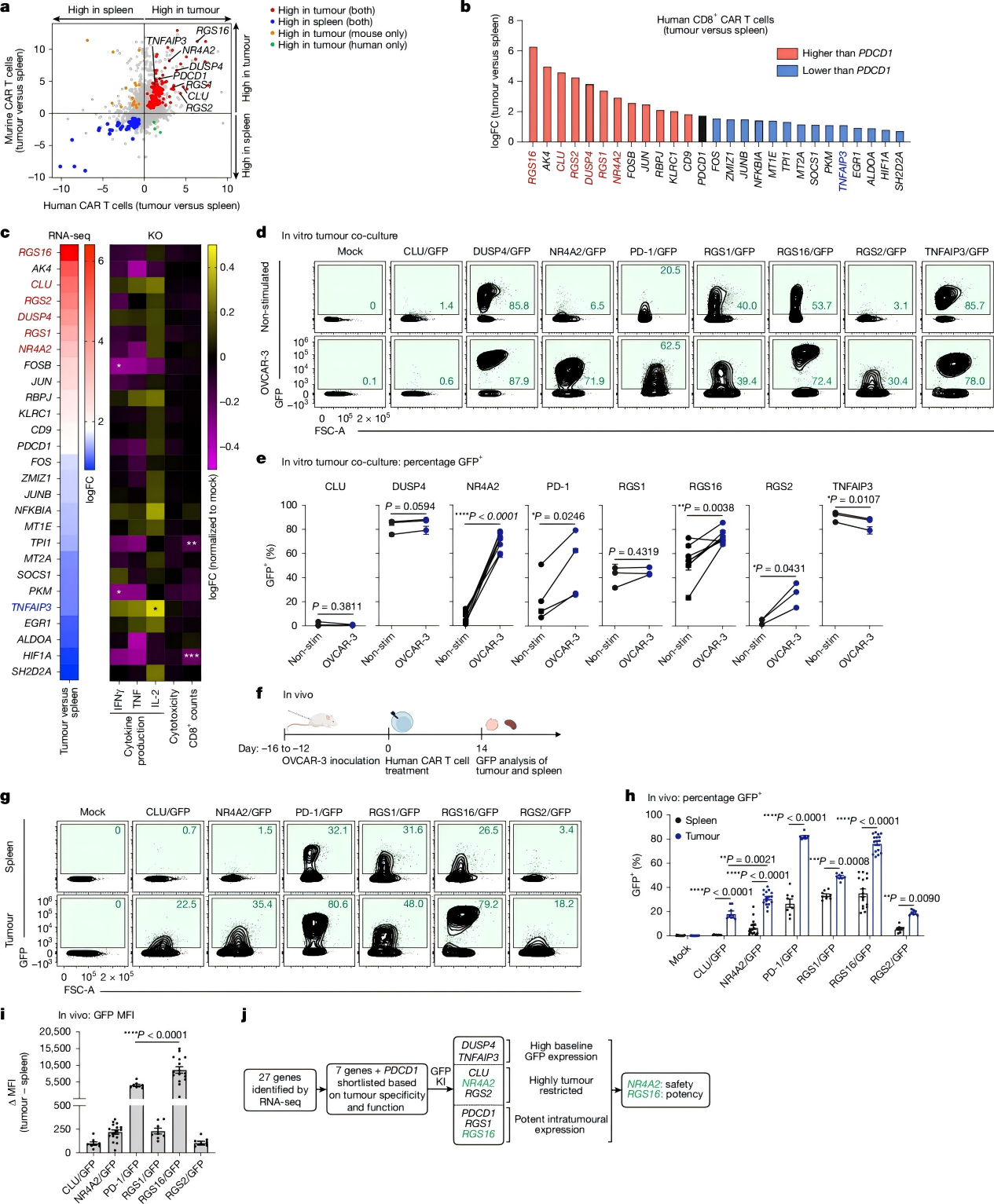
图 2. 识别CRISPR工程化装甲T细胞的最佳靶基因
在评估NR4A2/IL-12 OT-I细胞的治疗效果和安全性实验中,NR4A2/IL-12 OT-I细胞即使在较低剂量(1×10⁶个T细胞)时,效果依然得以保持,相比之下,NR4A2 KO组几乎没有治疗效果,证实疗效主要源于 IL-12 的局部表达而非 NR4A2 缺失本身。
随后,在晚期大体积肿瘤实验中,NR4A2/IL-12 小鼠 CAR-T 细胞仍能显著提升存活率且无毒性,而 NFAT-IL-12 组则迅速出现体重下降、弓背及活动减少。综上,Nr4a2 启动子可将 IL-12 表达严格限制在肿瘤部位,避免全身毒性。
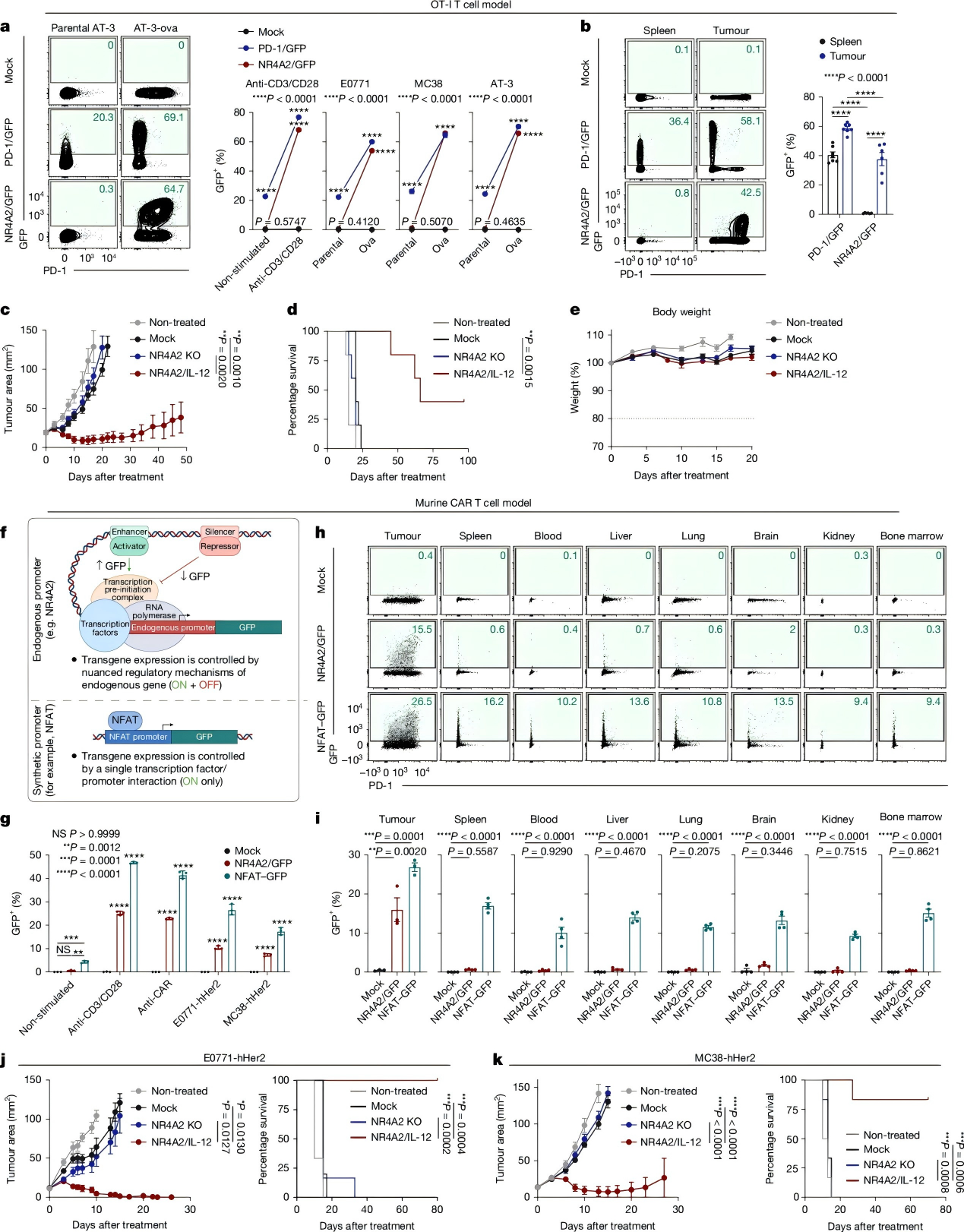
图 3. 优异的耐受性和强大的抗肿瘤免疫反应
为验证该策略在人类肿瘤模型中的疗效,研究团队首先构建了NR4A2/IL-12人源抗LeY CAR-T细胞,随后又改造出RGS16/IL-2 CAR-T细胞。
其中,RGS16/IL-2 CAR-T细胞不仅实现了更高水平的IL-2表达,还在体内显著抑制肿瘤生长,且未出现毒性反应。相关机制研究显示,该组CAR-T细胞的Ki67、IFNγ和TNF表达明显升高,肿瘤、脾脏及外周血中CD8⁺和CD4⁺ CAR-T细胞数量也显著增加。
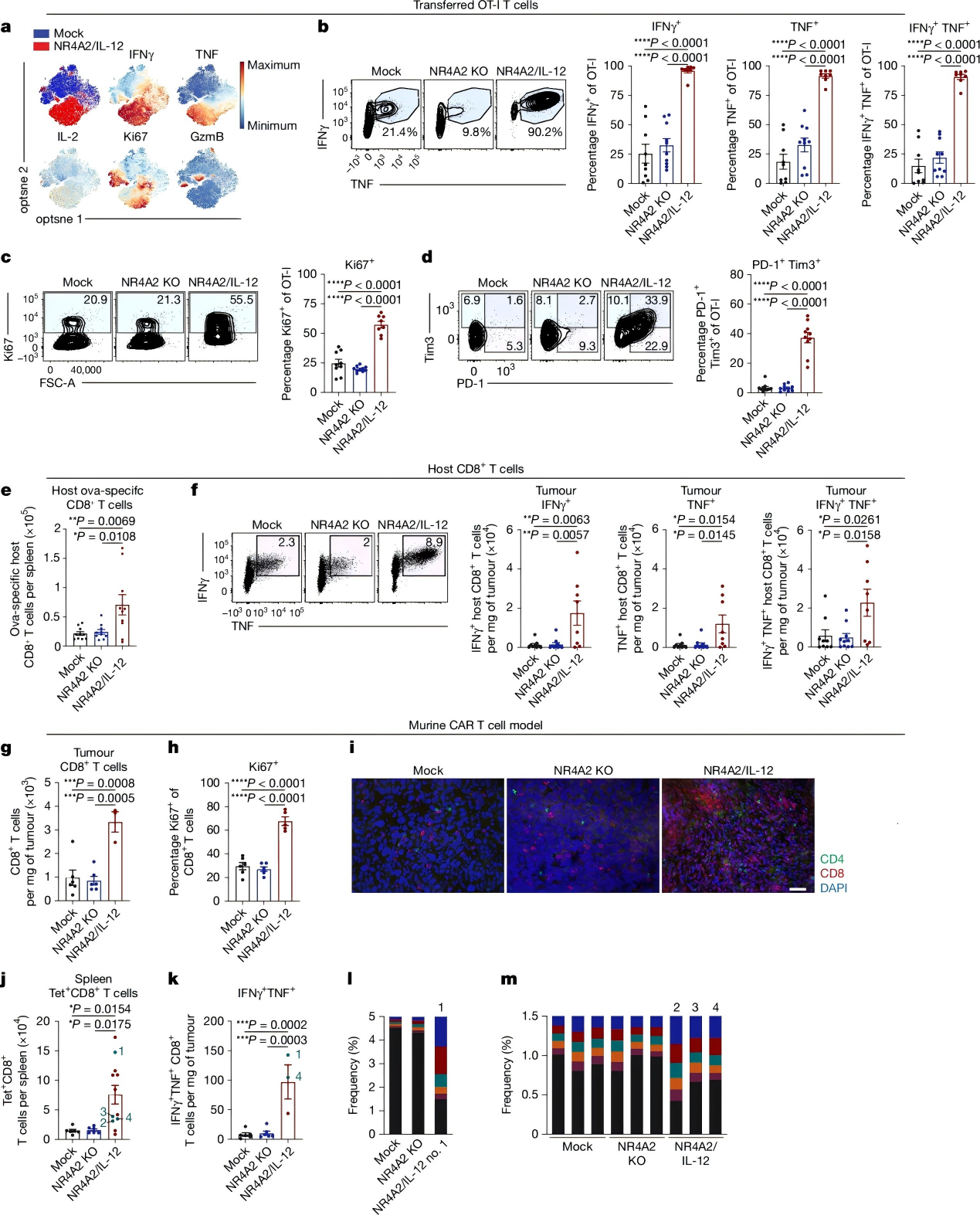
图 4. 增强的促炎性以及促进宿主抗肿瘤免疫反应
本研究利用内源性肿瘤限制性启动子(NR4A2、RGS16)驱动促炎因子IL-12或IL-2在肿瘤微环境内精准表达,显著增强CAR-T细胞的抗肿瘤活性并延长小鼠长期生存,同时对患者来源CAR-T细胞同样有效。未来,该方法有望突破实体瘤治疗瓶颈,为开发更安全、精准的过继细胞疗法提供新思路。
太阳集团城9661基因专注于CRISPR技术,提供一系列高质量的基因编辑服务和体外诊断产品:CRISPR文库筛选、细胞基因编辑、单克隆筛选、CRISPR检测,致力于为CRISPR相关、基因功能研究相关、体外诊断以及治疗相关的科学研究提供最高效的技术服务。














Comment (4)